А Е2О3
Б Е2О5
В ЕО
Г Е2О
2. Порядковий номер хімічного елемента дорівнює (2 відповіді):
А заряду ядра атома
Б кількості електронів
В кількості протонів
Г відносній атомній масі
3. Елемент з порядковим номером 15 має (2 відповіді):
Б 15 електронів
В 31 протон
Г ядро із зарядом +31
4. Кількість неспарених електронів в атомі Рубідію:
А 1
Б 2
В 3
Г 5
5. Сума коефіціентів у рівнянні горіння амоніаку за наявності каталізатора:
А 19
Б 15
В 21
Г 12
6. При взаємодії заліза і хлоридної кислоти утворюється:
А ферум (ІІІ) оксид і вода.
Б ферум (ІІ) хлорид і водень.
В ферум (ІІ) гідроксид.
Г ферум (ІІ) оксид і водень.
7. Оберіть назву вуглеводня C4H8:
А бутан
Б пентен
В бутен
Г бутин
8. Оберіть назву вуглеводня C3H4:
А пропин
Б октен
В пропан
Г октан
9. В які реакції вступають алкени та алкіни (ненасичені вуглеводні)?
А приєднання
Б заміщення
10. Яка речовина має назву "болотний газ":
А бензен
Б етен
В метан
Г пропін
11. При гідратації етену утворюється:
А пропанол
Б етиленгліколь
В бутан
Г етанол
12. При спалюванні пропану утворився вуглекислий газ об’ємом 15 л. Які об’єми вихідних речовин прореагували? (пишемо розв'язок до задачі)
А 15 л пропану 15 л кисню
Б 15 л пропану 45 л кисню
В 5 л пропану 25 л кисню
Г 3 л пропану 5 л кисню
1) Al + Fe2O3 →
2) CaCO3 + SiO2 →
3) SO3 + H2O →
4)NH3 + H2SO4 →
5) NH3 + HCl →
6) MgO + CO →
А вуглекислий газ
2. Складіть рівняння реакції сульфур (ІV) оксиду з водою і вкажіть хімічний характер утвореного гідрату:
А амфотерна основа
5. Позначте назву металу, який не вступає у хімічну взаємодію з розбавленою сульфатною кислотою (дивись ряд активності металів):
А магній
В мідь
А вуглекислий газ
А. Азот
Б. Кисень
В. Озон
1. О2
А CuSO4 + Ba(OH)2 →
Б H2SO4 + Mg(OH)2 →
В K2SO4 + BaCl2 →
S → SO2 → Н2SO3 → К2SO3
б) золота обручка
в) пластикова пляшка
г) кальцинована сода
а) гелію
б) азоту
в) кисню
г) води
д) вуглекислого газу
3. Який із наведених металів реагує з водою за кімнатної температури:
а) Hg
б) Na
в) Au
г) Zn
4. Cеред наведених формул виберіть формулу кальцій сульфіду:
а) CaSO4
б) CaSO3
в) CaS
г) CaS2O7
5. Вкажіть серед поданого переліку матеріалів силікатні матеріали:
а) скло
б) гума
в) цемент
г) фаянс
а) силікатна кислота;
г) натрій хлорид.
Fe → FeCl3 → Fe(OH)3 → Fe2O3
Задача 2. Який об'єм кисню (О2) потрібен для окиснення цинку (Zn) кількістю речовини 4 моль, якщо в результаті реакції утвориться цинк оксид (ZnO)?
Виконаний проект надсилаємо особистим повідомленням в Viber чи Telegram до 11.05.2022. Якщо виникатимуть питання - звертайтесь! Бажаю успіхів!
Створити навчальний проект на тему "Неорганічні речовини у фармації (або домашній аптечці)" в довільній формі (це може бути презентація, постер (плакат), повідомлення, реферат, відео-ролик тощо).
Завдання 2.
Складіть рівняння реакцій для здійснення таких перетворень:
а) S → SO2 → H2SO3 → Na2SO3
б) K → K2O → KOH → K2SO4
в) Сu → CuO → CuSO4 → Cu(OH)2
Завдання 3. Складіть генетичний ряд Магнію з речовин в наведеному переліку:
1. Максимальна кількість електронів на третьому енергетичному рівні дорівнює:
А 18;
Б 12;
В 8;
Г 2.
2. Укажіть характеристику лужних металів.
А хімічно найактивніші
Б мають найбільші значення електронегативності.
В плавляться при кімнатній температурі
Г у ряді активності металу розташовані після Гідрогену
3. Укажіть пари реагентів взаємодія яких відповідає скороченому йонному рівнянню реакції
Б KOH i KHSO4;
В NaOH i NaHSO4;
Г Cu(OH)2 i KHSO4;
4. Встановіть відповідність між назвою та формулою солі:
1) калій сульфат
2) калій хлорид
3) калій ортофосфат
4) калій сульфід
Б K3PO4;
В KCl;
Г K2S;
Д K2SO4.
варіанти відповідей
Б 1) - а); 2) - в); 3) - б); 4) - г).
В 1) - д); 2) - в); 3) - б); 4) - а).
5. Укажіть рівняння реакції нейтралізації:
А AgNО3 + HCl →AgCl + HNО3;
Б 2NaOH + СО2 → Na2CО3 + H2О;
В ZnCl2 + Na2CО3 → ZnCО3 + 2NaCl;
Г NaOH + HCl →NaCl + H2О;
6. Сума всіх коефіцієнтів у рівнянні реакції Al + O2 = Al2O3 дорівнює :
А 2
В 9
Г 5
|
№ досліду |
Назва досліду |
Опис досліду та спостереження |
Рівняння реакцій |
|
1. |
Встановлення якісного складу солі барій хлориду.
|
|
|
|
2. |
Розпізнавання якісного складу
солей, що містять йони Fe2+ та Fe3+:
|
|
|
Завдання 1. Опрацювати теоретичний матеріал та зробити короткий запис.
Жорсткість води - зумовлена наявністю йонів Са2+ і Мg2+,
називається загальною жорсткістю, яка ,в свою чергу, складається з тимчасової (карбонатної) та постійної (некарбонатної) жорсткості.
- у жорсткій воді погано розварюється мʹясо, овочі, бобові;
- продукти засвоюються організмом гірше;
- чай у жорсткій воді погано настоюється і втрачає свої смакові властивості.
- погано піниться милиться;
- вода з підвищеною тимчасовою жорсткістю непридатна для охолодження теплообмінної апаратури, оскільки при нагріванні карбонати осідають на стінках теплообмінника.
Завдання 1. Опрацювати параграф 27.
|
Формула
солі |
Назва
(хімічна та тривіальна (побутова)) |
Поширення
та застосування солі |
|
NaCl |
|
|
|
CaCO3 |
|
|
|
NaHCO3 |
|
|
|
NaNO3 |
|
|
|
CaSO4
· 2Н2О |
|
|
|
Na2SO4
· 10H2О |
|
|
Виконані завдання надсилаємо особистим повідомленням в Viber до 25.01.2021. Бажаю успіхів!
Особливості будови атомів металів:
- на зовнішьному енегретичному рівні містяться від 1 до 3 електронів;
- всі металічні елементи поділяються на s, p, d, f – елементи;
- d –елементи − винятково металічні елементи з 2 електронами;
- чим лівіше метал стоїть у ряду напруг, тим сильніша його відновна здатність;
- кожного металу існує металева кристалічна гратка та металевий хімічний зв’язок.
- Пластичність – зміщення шарів атомів, але завдяки переміщенню електронів по всьому кристалу розриву зв’язків не відбувається.
- Металічний блиск і сірий колір.
- Непрозорість.
- Електропровідність. Теплопровідність.
- Густина (найлегший Літій, а найважчий − Осмій).
- Легкоплавний – Ртуть.
- Тугоплавкий – Вольфрам.
- Найтвердіший метал − Хром.
- Найм’якіший метал − лужні метали.
а) Алюмінію (ІІІ) з Сульфуром (ІІ);
б) Фосфору (ІІІ) з Оксигеном (ІІ);
в) Карбону (ІV) з Сульфуром (ІІ);
г) Силіцію (ІV) з Оксигеном (ІІ);
д) Магнію (ІІ) з Нітрогеном (ІІІ);
е) Сульфуру (VІ) з Оксигеном (ІІ).
Задача 3. Визначте валентність елементів у нижчезазначених сполуках:
- якщо хлор одновалентний: MgCl2, AlCl3, KCl, PCl5, SiCl4;
- якщо сульфур двохвалентний: Li2S, BaS, PbS2, CS2, Al2S3.
1) СаО + Н2O =
2) Р2O5 +Н20 =
3) Lі + Н20=
4) Zn + Н20=
5) Lі20 + Н20 =
6) S03 + Н20 =
7) N2O5 +Н20 =
Особливості взаємодії нітратної кислоти з металами:
2) Малоактивні метали (Pb, Cu, Sn, Hg, Ag):
HNO3 + Me → Me(NO3)n + H2O + NO2
(конц.)
(конц.) бурий газ
HNO3 + Me → Me(NO3)n + H2O + NO
(розв.)
8HNO3 + 3Cu → 3 Cu(NO3)2 + 4H2O + 2NO
(розв.)
3) Метали середньої активності (Fe, Cr, Ni):
(конц.)
HNO3 + Me → Me(NO3)n + H2O + NO2 (NO, N2O)
(розв.)
4HNO3 + Ni → Ni(NO3)2 + 4H2O + 2NO2
(розв.)
8HNO3 + 3Ni → 3 Ni(NO3)2 + 4H2O + 2NO
(розв.)
4) Активні метали (Na, K, Ca, Mg, Zn):
З концентрованою нітратною кислотою не взаємодіє алюміній. (конц. - 60%)
a) HNO3 + Me → Me(NO3)n + H2O + NO ( NO2 )
(конц.)
8HNO3 + 3Zn → 3Zn(NO3)2 + 4H2O + 2NO (N2)
(конц.)
б) HNO3 + Me → Me(NO3)n + H2O + N2O
(розв.)
10HNO3 + 4Zn → 4Zn(NO3)2 + 5H2O + N2O (NН3)
в) HNO3 + Me → Me(NO3)n + H2O + NH4NO3
(сильно розв.)
10 HNO3 + 4Zn → 4 Zn(NO3)2 + 3H2O + NH4NO3
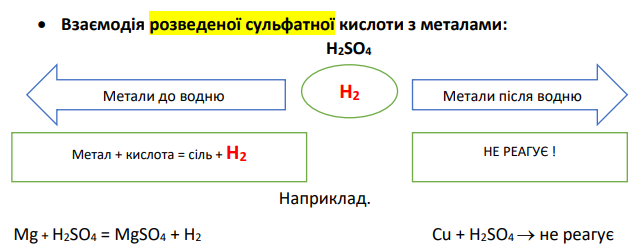
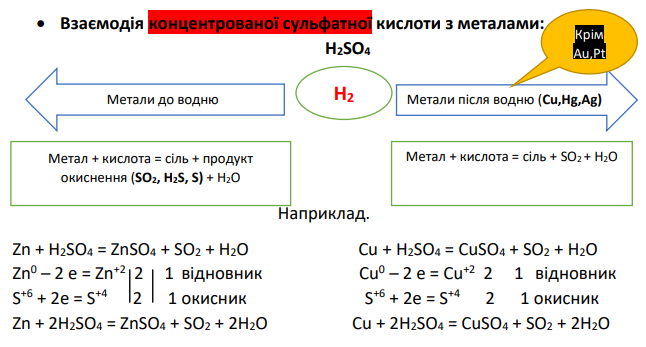
Особливості взаємодії сульфатної кислоти з металами
Самостійна робота:
А І
Б ІІ
В IV
Г VI
2. Потрібно приготувати розбавлену сульфатну кислоту. Необхідно:
А влити кислоту в воду
Б влити воду в кислоту
3. Сульфатна кислота буде реагувати з (декілька правильних відповідей)
А Магній
Б CO2
В HCl
Г К2О
Д КОН
Ж К
З Zn
4. Концентрована сульфатна кислота реагує з Cu. Виберіть речовини, що утворяться:
А CuSO3
Б CuSO4
В H2S
Г SO2
Д S
Ж H2
З H2O
5. Концентрована сульфатна кислота реагує з кальцієм. Оберіть які речовини утворяться:
А Ca2SO4
Б Ca2SO3
В CaSO4
Г H2S
Д SO2
Ж H2
З H2O
6. Вибрати метали, які не взаємодіють з кислотами:
А Ca
Б Cu
В Ag
Г AI
7. Тип реакції взаємодії кислоти з металами:
А розкладу
Б сполучення
В обміну
Г заміщення
А І
Б ІІ
В ІІІ
9. Якщо кислота потрапила на шкіру, то потрібно:
А нейтралізувати натрій гідроксидом
Б промити оцтом
В промити водою
Г нейтралізувати содою
10. При взаємодії концентрованої нітратної кислоти з малоактивними металами утворюється
А сіль+ NО2 + Н2О
Б сіль+ NО + Н2О
В сіль+ NО2
11. При взаємодії розбавленої нітратної кислоти з малоактивними металами утворюється:
А сіль + NО + Н2О
В сіль + NО2
Б 23
В 18
Г 14
Виконані завдання надсилаємо особистим повідомленням в Viber до 14.01.2021. Бажаю успіхів!
Завдання 1. Опрацювати параграф 21 стор. 120-122.
- Одноосновних безоксигеновмісних кислот
- Двохосновних оксигеновмісних кислот
- Трьохосновних кислот
- Двохосновних безоксигеновмісних кислот
| Назва кислоти | Формула кислоти | Тривіальна назва | Назва кислотного залишку | Фізичні властивості | Застосування |
| Хлоридна |
|
|
|
|
|
| Сульфатна |
|
|
|
|
|
| Сульфітна |
|
|
|
|
|
| Сульфідна |
|
|
|
|
|
| Нітратна |
|
|
|
|
|
|
Нітритна |
|
|
|
|
|
| Карбонатна |
|
|
|
|
|
| Ортофосфатна |
|
|
|
|
|
| Силікатна |
|
|
|
|
|
Тема: Котрольна робота з хімії за І семестр.
Виконану контрольну роботу надсилаємо особистим повідомленням в Viber протягом дня 29.12.2020.
а) 1S22S22p63S23p1; в) 1S22S22p63S2;
б) 1S22S22p63S23p6; г) 1S22S22p6.
а) -2; б) 0; в) -1.
а) HCl, б) Cl2, в) KClO3, г) Cl2О, д) Cl2О7.
а) 0; б) -1; в) +1.
а) йонний; б) ковалентний полярний; в) ковалентний неполярний.
Al2О3, Cu(NО3)2, Zn, H2SiО3, K2SО3, K2Cr2O7, O2, Сu.
Б – водневий 2. Na2SO4
В – йонний 3. Н2О
Г – полярний ковалентний 4. Mg
Д – неполярний ковалентний
Дата: 22.12.2020.
Тема: Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування.
Довідка:
Гідроген хлорид НС1 — безбарвний задушливий газ, добре розчинний у воді. Розчин відомий як хлоридна, або соляна, кислота.
У хімічних лабораторіях гідроген хлорид одержують шляхом нагрівання натрій хлориду з концентрованою сульфатною кислотою.
2NаС1 + Н2SO4
Згадайте, як необхідно збирати гідроген хлорид НС1? (Газ важчий за повітря, тому збирають, опустивши газовідвідну трубку в суху посудину)
2. Хлоридна кислота
1. Хлоридна кислота - сильний електроліт:
НС1
2. Взаємодія хлоридної кислоти з металами:
Zn + 2HCl → ZnCl2 + H2
3. Взаємодія хлоридної кислоти із цинк оксидом:
ZnO + 2HCl → ZnCl2 + H2O
4. Реакція нейтралізації:
NаОН + НС1 → NаС1 + Н2O
Виконанні завдання надсилаємо особистим повідомленням у Viber до 25.05.2020.
Дата: 19.05.2020.
Тема: Контрольна робота № 2.
Мета: перевірка та контроль знань учнів з хімії.
Виконанні завдання надсилаємо особистим повідомленням у Viber до 20.05.2020.
Дата: 14.05.2020.
Тема: Узагальнення: роль хімії у вирішенні сучасних глобальних проблем людства.
Мета: узагальнити знання з хімії та підготуватись до контрольної роботи.
Завдання: виконати вправи 1,2 та повторити матеріал (підготуватись до контрольної роботи за ІІ семестр).
Виконанні завдання надсилаємо особистим повідомленням у Viber до 15.05.2020.
Дата: 12.05.2020.
Тема: Навчальний проект: Підготовка есе «Роль хімії у моєму житті».
Мета: написати есе про роль хімії в повсякденному житті.
Завдання: написати есе "Роль хімії у моєму житті".
Виконанні завдання надсилаємо особистим повідомленням у Viber до 14.05.2020.
Дата: 07.05.2020.
Тема: «Зелена» хімія: сучасні завдання перед хімічною наукою та хімічною технологією.
Мета: показати роль хімії у вирішенні екологічної проблеми.
Завдання 1. Виписати термін "зелена хімія" та 12 принципів "зеленої хімії".
Завдання 2. Розвязати кросворд "Зелена хімія".
Виконанні завдання надсилаємо особистим повідомленням у Viber до 08.05.2020.
12 принципів Зеленої хімії:
- Запобігайте відходам, де тільки можливо.
- Сприяти розвитку «атомної економіки» (що означає максимізувати ефективність виробництва, щоб дало змогу, при створенні кінцевого продукту, виробленню меншої кількості шкідливих речовин).
- Синтезувати менш небезпечні хімічні речовини.
- Розробляти безпечні, не шкідливі речовини.
- В хімічних процесах використовувати безпечні розчинники та допоміжні речовини.
- Розробити енергозберігаючі хіміко-технологічні процеси.
- Використовувати поновлювальні джерела сировини.
- Уникнути або ж зменшити виробництво похідних речовин.
- Використовуйте каталізатори, оскільки більшість із них менше потребують матеріалів для виробництва.
- Диверсифікація шкідливих речовин, які розбиваються на нешкідливі продукти після їх використання.
- Сприяти проведенню аналізу, перш ніж виробляти небезпечні речовини.
- Сприяти розвитку безпечної хімії (використання безпечних форм речовин), щоб запобігти виникненню отруєння.
Тема: Роль хімії у розв’язанні екологічної проблеми.
Мета: показати роль хімії у вирішенні екологічної проблеми.
Завдання 1. Підготувати навчальний проект: Вирішення проблеми утилізації різних видів електричних ламп.
Завдання 2. Навести приклади позитивного і негативного значення хімічної промисловості.
Виконанні завдання надсилаємо особистим повідомленням у Viber до 07.05.2020.
Дата: 30.04.2020.
Тема: Роль хімії у розв’язанні сировинної проблеми.
Мета: показати роль хімії у вирішенні сировинної проблеми.
Завдання 1. Переглянути відеоролик "Роль хімії в розв’язанні сировинної проблеми".
Завдання 2. Виконати вправу (написати рівняння хімічних перетворень).
Як сировину для добування етину використовують кальцій карбід. З етину за допомогою певних перетворень можна добути речовини інших класів. Складіть рівняння реакцій за схемою та назвіть утворені речовини: СаС2 → С2Н2 → С2Н4 → С2Н5Сl → С2Н5ОН → СН3СООН → СН3СООС2Н5.
Виконанні завдання надсилаємо особистим повідомленням у Viber до 04.05.2020.
Дата: 28.04.2020.
Тема: Роль хімії у розв’язанні продовольчої проблеми.
Мета: показати роль хімії у вирішенні продовольчої проблеми.
Завдання 1. Виписати заходи спрямовані на розв’язання продовольчої проблеми і схему "Галузі харчової промисловості".
Завдання 2. Дайте обгрунтовану відповідь "Харчові добавки - добро чи зло?"
Виконанні завдання надсилаємо особистим повідомленням у Viber до 29.04.2020.
- Збільшення виробництва рослинної та тваринної їжі природного походження (застосування добрив та стимуляторів росту);
- Використання високовражайних сортів сільськогосподарських рослин та продуктивних порід тварин;
- Інтенсивний шлях розв’язання продовольчої проблеми передбачає механізацію та хімізацію.
Дата: 14.04.2020.
Тема: Генетичні зв’язки між основними класами неорганічних сполук.
Мета: розкрити взаємозв’язок явищ у природі на прикладі взаємоперетворень одних класів речовин на інші; узагальнити знання про неорганічні речовини та їх властивості; розвивати вміння порівнювати склад і властивості речовин, класифікувати речовини й реакції, встановлювати генетичний зв’язок між класами неорганічних сполук.
Завдання 1. Опрацювати теоретичний матеріал і оформити конспект уроку.
Виконанні завдання надсилаємо особистим повідомленням у Viber до 16.04.2020.
Завдання 2. Напишіть рівняння реакцій, щоб здійснити перетворення.
Завдання 3. Генетичний зв'язок Фосфору та його сполук ілюструє схема:
Теоретичний матеріал:
Тема: Узагальнення та систематизація знань з теми «Неорганічні речовини і їхні властивості».
Мета: узагальнити та систематизувати знання учнів з теми «Неорганічні речовини та їхні властивості».
Завдання: підготуватися до контрольної роботи з хімії № 2 та виконати вправи.
Виконанні завдання надсилаємо особистим повідомленням у Viber до 20.04.2020.
1. Вкажіть перелік, до якого ввійшли лише металічні елементи:
а) Al, O, P, Na; в) Zn, Fe, K, Al;
б) N, Zn, Co, S; г) Cl, C, Br, Н.
2. Речовина, з якою кальцій гідроксид не взаємодіє:
а) хлорид на кислота; в) цинк гідроксид;
б) сульфур(VI) оксид; г) карбон(IV) оксид.
3. Йони, які спричиняють жорсткість води:
а) Сu2+, Ca2+; в) Mg2+, K+;
б) K+, Ca2+; г) Ca2+, Mg2+.
4. Позначте фізичні властивості Алюмінію:
1. За звичайних умов рідка речовина;
2. Температура плавлення 0°С;
3. Має специфічний металічний блиск;
4. Прозора речовина;
5. Добре проводить електричний струм;
6. Пластична.
Варіанти відповідей:
а) 1, 2, 4; в) 2, 4, 6;
б) 3, 5, 6; г) 3, 4, 5.
5. Установити відповідність між металом та його особливістю:
1) золото; а) найпоширеніший;
2) алюміній; б) найактивніший;
3) францій; в) з найвищою електропровідністю;
4) вольфрам; г) найлегший;
д) найпластичніший;
е) найбільш тугоплавкий.
6. Знайти відповідність між формулою солі та її назвою:
1) Na3PO4; а) натрій гідрогенортофосфат;
2) CuSO3; б) алюміній гідрогенсульфід;
3) Fe(H2РO4)3; в) натрій ортофосфат;
4) Al(HS)3. г) купрум(II) сульфіт;
д) купрум(II) сульфат;
е) алюміній гідрогенсульфіт;
є) ферум(II) гідрогенортофосфат;
ж) ферум(III) гідрогенортофосфат;
з) ферум(III) дигідрогенортофосфат.
7. Скласти рівняння хімічних реакцій до схеми перетворень:
Дата: 21.04.2020.
Тема: Роль хімії у створенні нових матеріалів.
Сировиною називають природні матеріали, що використовуються у виробництві промислових продуктів.
Дата: 23.04.2020.
Тема: Роль хімії в розвитку нових напрямів технологій.
Завдання: написати рівняння рекцій.
Виконанні завдання надсилаємо особистим повідомленням в Viber до 27.04.2020.
.jpg)













Комментариев нет:
Отправить комментарий