1. Хімічний символ ____________
2. Номер групи __________
3. Номер періоду ___________
4. Кількість протонів _____________
5. Кількість електронів _____________
6. Кількість нейтронів ___________
7. Відносна атомна маса ____________
8. Заряд ядра ____________
9. Електронна формула ______________
10. Завершений чи незавершений зовнішній енегетичний рівень __________________________
11. Кількість неспарених електронів ____________________
12. Можливі валентності елемента _______________
Завдання 2. Виконайте тестові завданя 1-8:
А це відстань від центра ядра до сферичної поверхні з електронами останнього енергетичного рівня.
Б це відстань від останього енерганичного рівня до останьой орбіталі ,що заповнюється
В це енергія ,яку потрібно витратити атому для відриву електрона
2. Установіть послідовність зростання атома радіуса таких елементів: Бром,Йод, Хлор, Флуор:
А Флуор,Хлор,Бром,Йод
Б Бром,Йод, Хлор, Флуор
В Бром,Хлор, Флуор,Йод
Г Йод, Хлор, Флуор,Бром
3. В якому ряду елементів відбувається зростання радіуса атома:
А Be, Mg, Ca
Б Be, B, C
В Ве, Li, H
4. Максимальна кількість електронів на s орбіталі:
А 1
Б 2
В 32
Г багато
5. Вкажіть пари атомів, які мають однакову кількість енергетичних рівнів:
А 3 і 4
Б 3 і 11
В 29 і 30
6. Що спільного в будові атомів хімічних елементів з порядковими номерами 3 і 8:
А кількість електронів на зовнішньому енергетичному рівні
Б кількість енергетичних рівнів
В кількість електронів
7. Що спільного в будові атомів хімічних елементів з порядковими номерами 7 і 15:
А кількість електронів на зовнішньому енергетичному рівні
Б кількість електронів
В кількість енергетичних рівнів
8. Установіть послідовність зменшення радіуса атома таких елементів: Магній, Фосфор, Хлор, Сульфур:
А Магній, Фосфор, Хлор, Сульфур
Б Магній, Фосфор, Сульфур , Хлор
В Магній, Сульфур,Фосфор, Хлор
Г Фосфор,Магній, Сульфур , Хлор
Тема: Повторення вивченого матеріалу за ІІ семестр.
Виконайте тестові завдання 1-10:
А 3 елемента
Б 5 елементів
В 2 елемента
2. До якого класу неорганічних речовин належить сполука, що має назву кальцій карбонат?
А оксиди
Б кислоти
В основи
Г солі
3. Ковалентний зв'язок, під час якого відбувається зміщення електронних пар до більш електронегативного атома, називають:
А йонним зв'язком
Б ковалентним полярним зв'язком
В ковалентним неполярним зв'язком
Г металічним зв'язком
4. Йонним зв'язком називають хімічний зв'язок, утворений за допомогою електростатичної взаємодії:
А протилежно заряджених йонів
Б позитивно заряджених ядер
В неспарених електронів
5. Який тип хімічного зв'язку в речовині Н2?
А ковалентний полярний
Б ковалентний неполярний
В йонний
Г металічний
6. Визначте сполуку з ковалентним неполярним зв'язком
А N2
Б NH3
В NO2
Г HCl
7. Визначте сполуку з йонним зв'язком:
А LiCl
Б CO2
В F2
Г H2O

А водневий
В йонний
9. Кислоти з лакмусом дають забарвлення?
А червоне
Б синє
В зелене
10. Основи з лакмусом дать забарвлення?
А червоне
Б зелене
В синє
Г безбарвне
Тема: Контрольна робота № 2.
А m
Б n
В Vm
Г M
2. Яка фізична величина позначається символом D(н2):
А густина водню
Б стала Авогадро
В відносна густина за воднем
Г молярний об’єм
3. Укажіть одиницю вимірювання молярної маси:
А г/моль
Б г
В моль
Г 1/моль
4. Виберіть правильне твердження. Молярний об’єм – це:
А відношення кількості речовини до її об’єму
Б об’єм 1 моль речовини
В об’єм будь-якої порції речовини
Г стала величина за будь-яких умов
5. Виберіть значення молярної маси для кисню:
А 8 г/моль
Б 16 г /моль
В 32 г/моль
Г 64 г/моль
6. Який об’єм займає 0,25 моль будь-якого газу за н.у.:
А 11,2 л
Б 22,4 л
В 2,24 л
Г 5,6 л
7. Виберіть символ для позначення молярної маси:
А m
Б n
В Vm
Г M
8. Яка фізична величина позначається символом Nа:
А кількість речовини
Б стала Авогадро
В відносна густина газу
Г кількість атомів
9. Виберіть значення молярної маси для хлору (Cl2):
А 35,5
Б 35,5 г/моль
В 71 г/моль
Г 71г
10. Який об’єм займає 2,5 моль будь-якого газу за н.у.:
А 11,2 л
Б 22,4 л
В 56 л
Г 2,5 л
11. Виберіть значення молярної маси для азоту:
А 14 г/моль
Б 28
В 28 г/моль
Г 14 г
12. Який об’єм займає 0,1 моль будь-якого газу за н.у.:
А 11,2 л
Б 22,4 л
В 2,24 л
Г 5,6 л
2. 2,8 г N2
3. 14,2 г Cl2
4. 480 г O3
Б 4 моль
В 0,2 моль
14. Заповніть таблицю, виконавши розрахунки:
N (CO2), молекул | M (CO2), г/моль | n (CO2), моль | m (CO2), г | V (CO2), л |
6,622×1023 |
|
|
|
|
Завдання 1. Заповнити пропуски в таблиці.
Завдання 3. Перекласти рідною мовою такі вирази (замість назв хімічних елементів напишіть назви речовин, слова, які потрібно перекласти виділено):
1. Не все те Аурум, що блищить.
2. Ферумний характер.
3. За купрумний гріш подавився.
4. Перший день гість – Аурум, другий – Аргентум, а третій – Купрум, бери сумку та їдь.
5. Білий, як Кальцій карбонат.
6. Слово – Аргентум, а мовчання - Аурум.
7. Багато Аш два О утекло.
8. Щоби друга пізнати, потрібно з ним пуд Натрій хлориду з'їсти.
Завдання 4. Після уведення у комп'ютер результатів лабораторних досліджень загубилися деякі формули речовин. Допоможіть визначити можливі варіанти, якщо частина інформації збереглася:
CuCl2 + _____ = Cu(OH)2 + ______
CaCO3 + ______ = _____ +CO2 + H2O
Ba(NO3)2 + … = BaSO4 + …
Розрахуйте кількість речовини алюмінію (АІ), який небхідний для отримання 1,5 моль водню (Н2) при реакції з соляною (хлоридною) кислотою (НСІ).
Виконані завдання надсилаємо особистим повідомленням в Viber чи Telegram до 18.05.2022. Якщо виникатимуть питання - звертайтесь! Бажаю успіхів!
Який об'єм кисню (О2) потрібен для окиснення цинку (Zn) масою 130 грам, якщо в результаті реакції утвориться цинк оксид (ZnO)?
Обчисліть масу натрій гідроксиду (NaOH), який утвориться при взаємодії натрій оксид (Na2O) кількістю речовини 3 моль з водою.
|
Номер досліду |
Схема рекції (допишіть рівняння реакції) |
Спостереження
|
Формула та колір осаду |
|
1 |
NaCl + AgNO3
→ |
|
|
|
2 |
Na2SO2
+ BaCl2 → |
|
|
|
3 |
Na3PO4
+ AgNO3 → |
|
|
Виконану практичну роботу надсилаємо особистим повідомленням в Viber чи Telegram до 01.05.2022. Якщо виникатимуть питання - звертайтесь! Бажаю успіхів!
Мета: закріпити знання про хімічні властивості оксидів, кислот, основ і солей.
Повторення правил безпеки життєдіяльності (перегляньте відео)
Переглянути демонстраційний Дослід 1. запишіть рівняння реакції та спостереження в таблицю.
3.1 Взаємодія лугів із солями. Переглянути демонстраційний Дослід 3.1, записати відповідні рівняння реакцій та спостереження в таблицю.
4. Властивості солей. Взаємодія металів з солями. Переглянути демонстраційний Дослід 4, записати відповідні рівняння реакцій та спостереження в таблицю.
|
№ досліду |
Назва досліду |
Рівняння реакції (дописати і вказати тип реакції) |
Спостереження та
висновки |
|
Дослідження властивостей
оксидів |
|||
|
1 |
Взаємодія кальцій оксиду з
водою |
CaO + H2O → |
|
|
Дослідження властивостей кислот |
|||
|
2 |
Взаємодія хлоридної кислоти з металами (Zn, Sn, Cu) |
Zn + HCl → Sn + HCl → Cu + HCl → |
|
|
Властивості основ |
|||
|
3.1 |
Взаємодія лугів із солями |
FeCl3 + NaOH → Na2SO4
+ Ba(OH)2 → Na2SO4
+ KOH →
|
|
|
3.2 |
Взаємодія лугу з кислотами.
Реакція нейтралізації |
NaOH + HCl → NaOH + H2SO4
→ KOH + HCl → KOH + H2SO4 → |
|
|
Властивості
солей |
|||
|
4 |
Взаємодія металів з солями |
CuSO4 + Zn → ZnSO4 + Cu → |
|
Зробіть висновок до практичної роботи.
а) S → SO2 → H2SO3 → Na2SO3
б) K → K2O → KOH → K2SO4
в) Сu → CuO → CuSO4 → Cu(OH)2
Кислоти: ________________________________________.
Основи: ________________________________________.
Солі: ________________________________________.
BaСl2 + Н2SO4 →
MgО + Н2SO4 →
Ba(OH)2 + Н2SO4 →
MgСО3 + Н2SO4 →
Завдання 3. Здійснити перетворення
ZnSO4 + Fe(OH)2 →
FeCl2 + Na →
K2SiO3 + H3PO4 →
HgSO4 + Mg →
MgSO3 + HCl →
Завдання 3. Напишіть хімічні формули солей:
1) Алюміній сульфату ____________________
2) Алюміній хлориду ____________________
3) Алюміній ортофосфату ____________________
4) Алюміній сульфіду ____________________
Завдання 4. Напишій рівняння реакції між барій хлоридом і калій сульфатом та назвіть продукти реакції.
Завдання 2. Охарактеризуйте фізичні властивості середніх солей, заповнити таблицю "Фізичні властивості солей".
1. HCl + Be(OH)2→
2. H2SO4 + Cr(OH)3 →
3. Cr(OH)3 + NaOH →
4. Sn(OH)2 + LiOH →
5. ZnO + HCl →
6. SnO + KOH →
Cu(OH)2 = CuO + H2O
Fe(OH)2 = FeO + H2O
Сu(ОН)2 + HCl = CuCl2 + H2O
Сu(ОН)2 + H2SO4 = CuSO4 + H2O
Завдання 3. Розв'яжіть задачу:
Що спільного між цими рівняннями хімічних реакцій? Так, те, що в реакцію вступає одна складна та одна проста речовини й утворюються одна проста й одна складна. Такі реакції називають реакціями заміщення.
а) цинк + сульфітна кислота →_________________
б) купрум + ортофосфатна кислота →______
в) магній + сульфатна кислота →_____________________
г) натрій + хлоридна кислота →______________
д) срібло + хлоридна кислота →______________________
1)P + O2 =
2) H3PO4 + CaO =
3) K2SO3 + HCl =
4) H3PO4 + LiOH =
5) Zn(OH)2 + HCl =
6) ZnO + HCl =
7) ZnO + NaOH =
8) ZnO + SO3 =
9) K2SO3 + HCl =
10) FeCl3 + AgNO3 =
11) SO3 + KOH =
12)SO3 + H2О =
1. Вкажіть
формулу речовини, з якою реагує сульфатна кислота Н2SO4:
А Si
Б H2O
В HCl
Г NaOH
2. Вкажіть
реакцію обміну:
А CaO + H2O ®
Ca(OH)2
Б 2Li + 2HCl ® 2LiCl + H2
В CaO + H2SO4 ® CaSO4 + H2O
Г 2H2O2
®
2H2O + O2
3. Вкажіть
метал, який НЕ взаємодіє з хлоридною кислотою
HCl (дивись ряд активності металів):
А Ca
Б Cu
В Zn
Г Fe
4. Визначте
формулу речовини Х в схемі реакції X + 2HBr ®
CaBr2
+ H2
А CaSO4
Б CaO
В Ca
Г Ca(OH)2
5. Вкажіть
метал, який найенергійніше реагує з сульфатною кислотою:
А Ca
Б Cu
В K
Г Al
6. Вкажіть
групу речовин, в якій всі реагують з кислотами:
А Ca, CO2
Б CaO, Ca(OH)2
В CaO, Cu
Г Ca(OH)2, N2O5
7. Вкажіть
групу металів, в якій всі реагують з кислотами:
А Hg, Al, Na
Б Ca, Cu, Cr
В Al, Cr, Mn
Г Hg, Pt, Pb
8. Вкажіть
продукт взаємодії магнію з розбавленою сульфатною кислотою:
А MgSO4
Б MgSO3
В MgS
Г MgCO3
9. Вкажіть
реакцію заміщення:
А CaO + H2O ®
Ca(OH)2
Б 2Li + 2HCl ® 2LiCl + H2
В CaO + H2SO4 ® CaSO4 + H2O
Г 2H2O2
®
2H2O + O2
10. Вкажіть
метал, який не взаємодіє з сульфатною кислотою
H2SO4:
А Ag
Б Al
В Na
Г Mn
11. Вкажіть
пару речовин, в якій речовини прореагують між собою:
А CO2, HNO3
Б Ag, HCl
В Ca, H2SO4
Г HCl, NaCl
12. Вкажіть
продукт взаємодії магнію з ортофосфатною кислотою:
А Mg3(PO4)2
Б Mg3P2
В Mg(PO3)2
Г Mg3(PO3)2
1. Класифікувати речовини на оксиди, кислоти, солі та основи:
CO2, Ca(OH)2, FeCl3, Na, O2, H2SO4, HBr, K2S, Li2O, Fe(OH)3, Cu(NO3)2, Cr2O3, Cu, H2.
2. Дописати рівняння (якщо реакція з металами, то необхідно перевірити чи реагує метал з допомогою ряду активності металів) та
визначити типи реакцій:
1) Ca + H2SO4 →
2) SO2 + Na2O→
3) HCl + NaOH →
4) Zn + H2SO4 →
5) Ag + H2SO4 →
6) Al + H3PO4 →
7) Hg + HCl→
8) Mg(OН)2 + H2SO4→
9) CaCl2 + H2SO4 →
10) Cu(NO3)2 + H2S →
11) KOH + H3PO4 →
Тема: Хімічні властивості кислотних оксидів: взаємодія з водою, кислотами, лугами, іншими оксидами.
1. Укажіть ряд кислотних оксидів:
а) H2SO4, HCl, H2CO3, HNO3, H3PO4;
б) NaOH, KOH, Mg(OH)2, Ca(OH)2;
в) MgO, CaO, FeO, NiO, BaO;
г) NO2, SO2, CO2, SiO2, P2O5.
2. Вкажіть назву речовини, формула якої P2O5:
а) фосфор (ІІІ) оксид;
б) фосфор (V) оксид;
в) метафосфатна кислота;
г) ортофосфатна кислота.
Силіцій оксид SiO2 з водою не реагує.
3. Кислотні оксиди можуть реагувати з основними (та амфотерними) оксидами:
Mg, O2, BaO, C, FeSO4, CuO, H2CO3, NaOH, Al, H2, Fe2O3.
| Оксиди | Кислоти | Основи | Солі |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Назва оксиду | Формула оксиду |
| а) Кальцій оксид | 1) CO |
| б) Карбон (IV) оксид | 2) CaO |
| в) Карбон (ІІ) оксид | 3) CO2 |
| г) Нітроген (І) оксид | 4) N2O |
| д) Натрій оксид | 5) Na2O |
| е) Калій оксид | 6) K2O |
Загальна формула оксидів – ExOy.
Назви оксидів для елементів зі сталою валентністю:
Наприклад: Na2O – натрій оксид, CaO – кальцій оксид.
Назва оксидів для елементів зі змінною валентністю:
Кислоти – складні речовини, що містять атоми Гідрогену та кислотний залишок.
У формулах кислот на першому місці пишуть символ Гідрогену, а інші символи позначають склад кислотного залишку.
Загальна формула кислот – НК , де Н - Гідроген, К - кислотний залишок (-SO4, -SO3, -Cl, -PO4)/
Назви кислот складають так:
Нn + кислотний залишок, наприклад: H2SO4 (аш 2 ес о 4, або сульфатна кислота), HNO3 (аш ен о 3, або нітратна кислота).
Основи (гідроксиди) – складні речовини, що містять атоми металічного елемента (Ме) та одну або декілька гідроксогруп (ОН).
Загальна формула основ – Ме(ОН)х.
Назви основ для елементів зі сталою валентністю:
Назви основ для елементів зі змінною валентністю:
Наприклад: Fe(OH) – ферум (ІІ) гідроксид, Cu(OH) – купрум (ІІ) гідроксид.
Серед основ виділяють дві групи: луги (розчинні гідроксиди) та нерозчинні гідроксиди.
Солі – складні речовини, що містять йони металічних елементів та кислотні залишки.
Наприклад, Ba SO4, Ca Cl2.
Назви солей для елементів зі сталою валентністю:
Наприклад: K2SO3 – калій сульфат, CaCO3 – кальцій карбонат.
Назви солей для елементів зі змінною валентністю:
Наприклад: FeSO4 – ферум (ІІ) сульфат, CuCl2 – купрум (ІІ) хлорид.
Тема: Узагальнення знань з теми "Кількість речовини. Розрахунки за хімічними формулами".
1. Фізична величина, що характеризується числом структурних частинок речовини у певній її порції:
А молярна маса
Б кількість речовини
В число Авогадро
Г молярний об'єм
А 22,4
Б 11,2
В 6,02*1023
Г 3,01*1023
А г
Б моль
В г/моль
Г л/моль
4. Яких речовин стосується поняття «Молярний об'єм»:
А твердих речовин
Б рідин
В газів
Г усіх речовин
А 0,4 г
Б 6,4 г
В 3,2 г
Г 64 г
6. Яка кількість речовини міститься в 3 г водню:
А 3 моль
Б 6 моль
В 1,5 моль
Г 0,1 моль
7. 2 моль вуглекислого газу за нормальних умов займають об'єм:
А 88 л
Б 64 л
В 44,8 л
8. Чому дорівнює відносна густина кисню за воднем:
А 0,125
Б 16
В 0,0425
Г 32
9. Молярна маса міді:
А 56 г/моль
Б 14 г/моль
В 32 г/моль
Г 64 г/моль
10. Маса вуглецю (С) кількістю речовини 0,1 моль:
А 12 г
Б 0,6 г
В 1.2 г
Г 6 г
11. Кількість атомів Оксигену вSO2 кількістю речовини 0,5 моль:
А 3,01*1023
Б 6,02*1023
В 0,301*1023
Г 0,6*1023
12. Маса 1,5 моль CuO:
А 80 г
Б 160 г
В 120 г
Г 12 г
Тема: Розрахункові задачі. Обчислення з використанням відносної густини газів.
Задача 1. Обчисліть відносну густину карбон (IV) оксиду за воднем.
Задача 2. Обчисліть відносну густину карбон (ІІ) оксиду за повітрям (М (повітря) = 29).
| Формула газу | Відносна густина за повітрям |
| а) СО | 1) 2,2 |
| б) CO2 | 2) 0,97 |
| в) SO2 | 3) 1,52 |
| г) NO2 | 4) 1,59 |
Дата: 12.01.2021.
Відносна густина газів - це безрозмірна величина, що показує у скільки разів один газ важчий або легший за інший.
Позначається відносна густина газів - D.
Виконані завдання надсилаємо особистим повідомленням в Viber до 30.12.2020.
Ж.Л.Гей-Люссак, досліджуючи гази, виявив, що під час хімічних реакцій їхні об’єми відносяться між собою як невеликі цілі числа. Ці числа відповідають коефіцієнтам, поставленим у рівняннях реакцій. Цей закон називається законом об’ємних відношень або законом Гей-Люссака. Учений довів, що цей закон є справедливим за умови, коли об’єми газів виміряні за однакових температур і тиску.
Розрахуємо об’єми речовин з урахуванням нормальних умов.
Нормальні умови (скорочено н. у.) - стандартні набори умов для експериментальних вимірювань які створені для порівняння різних даних.
За IUPAC нормальні умови:
температура 0°С;
абсолютний тиск 100,00 кПа.
Ми розраховували об’єми речовин кількістю 1 моль. Знайшли закономірність: об’єми газів однакові (за однакових умов рівні кількості різних газів займають рівні об’єми).
Це відношення названо молярним об’ємом:
Vm = 22,4 л\моль.
Закон Авогадро: В однакових об’ємах різних газів міститься однакова кількість молекул. На основі цього закону справедливим буде обернене твердження: Однакова кількість молекул різних газів за однакових умов займатиме однаковий об’єм.
Знаючи молярний об’єм газу, можна визначати кількість речовини, об’єм будь-якої кількості речовини, масу та кількість структурних частинок в певному об’ємі газу.
Формули для обчислення:
Задача 1: Розрахуйте кількість речовини натрій хлориду (NaCl) масою 125 г.
Тема: Віртуальна екскурсія: Підприємства хімічної промисловості України.
Завдання: переглянути відеоролики "Виробництво шин. Як це?", "Фармацевтична фірма Дарниця".
Дата: 22.05.2020.
Тема: Хімічна наука і виробництво в Україні. Видатні вітчизняні вчені – творці хімічної науки.
Завдання 2. Заповнити таблиці "Зарубіжні науковці-хіміки і їх внесок" та "Вітчизняні науковці-хіміки" (коротко).
Зарубіжні науковці-хіміки
|
Їх внесок
|
Вітчизняні науковці-хіміки
|
Їх внесок
|
Тема: Роль хімічної науки для забезпечення сталого розвитку людства.
Завдання 2.
- Наведіть приклади хімічних процесів у природі.
- Підготуйте повідомлення "Хімія: користь чи шкода!".
Виконанне завдання надсилаємо особистим повідомленням в Viber до 16.05.2020.
Дата: 15.05.2020.
Тема: Місце хімії серед наук про природу, її значення для розуміння наукової картини світу.
Мета: поглибити знання учнів про роль хімії.
Завдання 2. Як хімія пов'язана з іншими науками? Відповідь обгрунтуйте.
Виконанне завдання надсилаємо особистим повідомленням в Viber до 16.05.2020.
Дата: 14.05.2020.
Тема: Багатоманітність речовин та хімічних реакцій. Взаємозв’язки між речовинами та їхні взаємоперетворення.
Мета: узагальнити знання учнів про речовини та їх багатоманітність, взаємозв’язки між речовинами та їх взаємоперетворення.
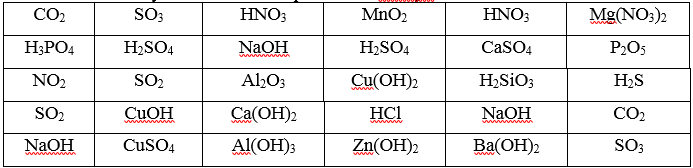
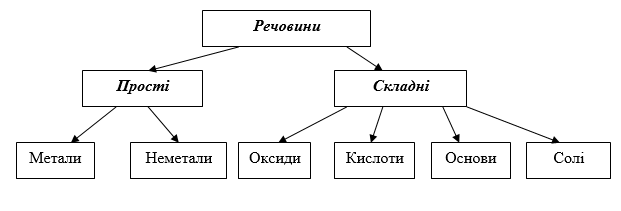
Завдання 2. Оформити схему "Класифікація хімічних речовин".
Завдання 3. Виконати контрольні завдання 1-7.
Виконанні завдання надсилаємо особистим повідомленням в Viber до 15.05.2020.
Завдання: підготувати навчальний проект.
Виконанні завдання надсилаємо особистим повідомленням в Viber до 14.05.2020.
Завдання: підготувати навчальний проект.
Дата: 30.05.2020.
Контрольну роботу надсилаємо особистим повідомленням в Viber до 08.05.2020-09.05.2020.
Дата: 07.05.2020.
Тема: Узагальнення знань з теми «Початкові поняття про органічні сполуки».
Мета: узагальнити та систематизувати знання з теми «Органічні сполуки»; закріпити навички складання назв та формул органічних сполук; закріпити вміння складання хімічних реакцій.
Завдання 1. Виконати вправи 1, 2.
Завдання 2. Повторити наступні терміни: органічні сполуки, гомологи, гомологічний ряд, вуглеводні, алкани, алкени, алкіни, спирти, карбонові кислоти, жири, вуглеводи, поліпептиди, радикал, ізомери, функціональна група, кратний звязок, елементи органогени.
Підготуватися до контрольної роботи.
Виконанні завдання надсилаємо особистим повідомленням в Viber до 08.05.2020.
Тема: Значення природних і синтетичних органічних сполук. Захист довкілля від стійких органічних забруднювачів.
Мета: ознайомитися з природними і синтетичними органічними сполуками .
Завдання 2. Оформити схему.
Завдання 3. Виконати вправа 1,2.
Виконанні завдання надсилаємо особистим повідомленням в Viber до 06.05.2020.
Дата: 26.03.2020.
Тема: Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів.
Мета: сформувати знання про склад, утворення, будову жирів, з’ясувати фізичні властивості, галузі застосування, способи одержання жирів.
Завдання 1. Опрацювати теоретичний матеріал і оформити конспект уроку.
Завдання 2. Виконати самостійну роботу.
Виконанні завдання надсилаємо особистим повідомленням у Viber до 27.03.2020.
Теоретичний матеріал:
Історія вивчення жирів пов’язана із прізвищами двох французьких вчених. У 1817р М. Шеврель нагрів жир з водою в лужному середовищі. В результаті реакції він отримав гліцерин та суміш карбонових кислот.
У 1857р П. Бертло проробив зворотну реакцію, він нагрів гліцерин з вищими карбоновими кислотами і отримав жир.
Жири – естери трьохатомного спирту гліцерину та вищих карбонових кислот.
Утворення жирів. Жири – продукти реакції етерифікації:
СН2 ─ ОН НООС-R1 CН2 ─ О ─ СО ─R1
│ │
СН ─ ОН + НООС-R2 → CН ─ О ─ СО ─R2 + 3Н2О
│ │
СН2 ─ ОН НООС-R3 CН2 ─ О ─ СО ─R3
Глицерин Карбонові Жир
кислоти
Склад жирів. До складу молекули жиру входять залишки гліцерину та карбонових кислот. R – радикал кислоти, що містить від 3 до 25 атомів Карбону. Цікаво, що до складу природних жирів входять карбонові кислоти лише з парним числом атомів Карбону. Найпоширеніші кислоти, що входять до складу жирів:
Насичені карбонові кислоти:
С17Н35 СООН стеаринова кислота
С15Н31 СООН пальмітинова кислота
С3Н7 СООН масляна кислота
Ненасичені карбонові кислоти (містять кратний зв"язок):
С17Н33 СООН олеїнова кислота
С17Н31 СООН лінолева кислота
С17Н29 СООН ліноленова кислота
Склад жирів визначає їх агрегатний стан. Тверді жири містять залишки переважно насичених кислот, рідкі – переважно ненасичених.
CН2 ─ О ─ СО ─ С17Н35 СН2 ─ О ─ СО ─ С17Н33
│ │
СН ─ О ─ СО ─ С17Н35 СН ─ О ─ СО ─ С17Н33
│ │
СН2 ─ О ─ СО ─ С17Н35 СН2 ─ О ─ СО ─ С17Н33
Тристеарин (твердий жир) Триолеїн ( рідкий жир)
Фізичні властивості жирів
Тваринні жири – тверді ( виняток – риб’ячий жир),
Рослинні жири – рідкі ( виняток – кокосове масло).
Легші за воду.
Нерозчинні у воді, але розчиняються в органічних розчинниках, наприклад, в бензині.
Добре вбирають запахи, (тому застосовуються в парфумерії).
Хімічні властивості жирів
1) Реакції окиснення. Під час тривалого зберігання на повітрі під дією тепла і світла жири гіркнуть, з’являється неприємний запах і смак.
Дата: 27.03.2020-02.04.2020-03.04.2020.
Тема: Вуглеводи: глюкоза, сахароза, крохмаль, целюлоза. Крохмаль і целюлоза – природні полімери. Застосування вуглеводів, їхня біологічна роль.
Мета: ознайомити учнів із класифікацією вуглеводів, їх фізичними властивостями; показати поширення вуглеводів у природі, значення для життєдіяльності живих організмів і людини, застосування.
Завдання 1. Опрацювати теоретичний матеріал і оформити конспект уроку.
Завдання 2. Хімічний диктант.
Виконанні завдання надсилаємо особистим повідомленням в Viber до 15.04.2020.
Теоретичний матеріал:
Вуглеводи — це органічні речовини, склад яких можна виразити загальною формулою Сn(Н2О)m .
Вуглеводи утворюються в процесі фотосинтезу:
Моносахариди
|
Дисахариди
|
Полісахариди
| |
Гексози
(6 атомів
Карбону)
|
Пентози
(5 атомів
Карбону)
| ||
Глюкоза
|
Рибоза
|
Сахароза
|
Крохмаль
|
Фруктоза
|
Дезоксирибоза
|
Мальтоза
|
Целлюлоза
|
Галактоза
|
Лактоза
|
Глікоген
| |
С6Н12O6
|
С5Н10O5(4)
|
С12Н22O11
|
(С6Н10O5)n
|
Дата: 16.04.2020-17.04.2020
Тема: Нітрогеновмісні органічні речовини. Поняття про амінокислоти. Білки як біологічні полімери. Денатурація білків. Біологічна роль амінокислот і білків.
Мета: формування поняття про білки як природні полімери та їх значення в житті людини; про склад та структуру білкових молекул: первинну, вторинну, третинну, четвертинну; фізичні та хімічні властивості на прикладі денатурації.
Завдання 1. Опрацювати теоретичний матеріал і оформити конспект уроку.
Завдання 2. Виконати самостійну роботу.
Виконанні завдання надсилаємо особистим повідомленням в Viber до 28.04.2020.
Теоретичний матеріал:
Білки - біополімери, мономерами, яких є амінокислоти - відносно низькомолекулярні сполуки.
Структура білка
|
Просторова конфігурація
|
Первинна
А - А - А – А |
Послідовне, лінійне сполучення залишків
амінокислот за допомогою пептидних зв'язків.
|
Вторинна
|
Спосіб упакування первинної структури в альфа-спіраль або бета-шар.
Альфа-спіраль виникає в результаті утворення водневих зв`язків між групами
-СО- та -NH, розташованих на різних витках спіралі. Бета-шар утворюється
в результаті формування водневих зв`язків між СО-групами одного
поліпептидного ланцюга та NH-групами іншого поліпептидного ланцюга
|
Третинна
|
Спосіб упакування альфа-спіралі у просторову глобулу. Утворюється завдяки
додатковим водневим зв`язкам, гідрофільно-гідрофобним взаємодіям та
ковалентним дисульфід ним зв`язкам -S-S-, які виникають між двома молекулами
цистеїну
|
Четвертинна
|
Декілька глобул.
|

















Комментариев нет:
Отправить комментарий